- Geschäftsprozessmanagement (BPM)Dokumenten-Management-System (DMS)Elektronisches Qualitätsmanagementsystem (QMS)Risk, Governance & Compliance (GRC)Schnelle Anwendungsentwicklung mit wenig Code (LC)Betriebliches Kontinuitätsmanagement (BCM)Unternehmensarchitektur (EA)Geschäftsprozessmanagement (BPM)
- Geschäftsprozessmanagement Übersicht
- AI Prozess-Parsing, -Generierung, -Analyse & -Verbesserung
- Prozess-Mapping / Modellierung
- Prozess-Analyse und Verbesserung
- Prozess-Simulation
- Prozess-Mining
- Zusammenarbeit & Governance
- Data Migration und Integration
- Anbindung der Offline-App
 Dokumenten-Management-System (DMS)
Dokumenten-Management-System (DMS)- Dokumentenlenkung Übersicht
- KI-Inhaltserstellung und -verbesserung
- Verwaltung von Richtlinien und Verfahren (SOP)
- Zusammenarbeit & Governance
- Data Migration und Integration
- Anbindung der Offline-App
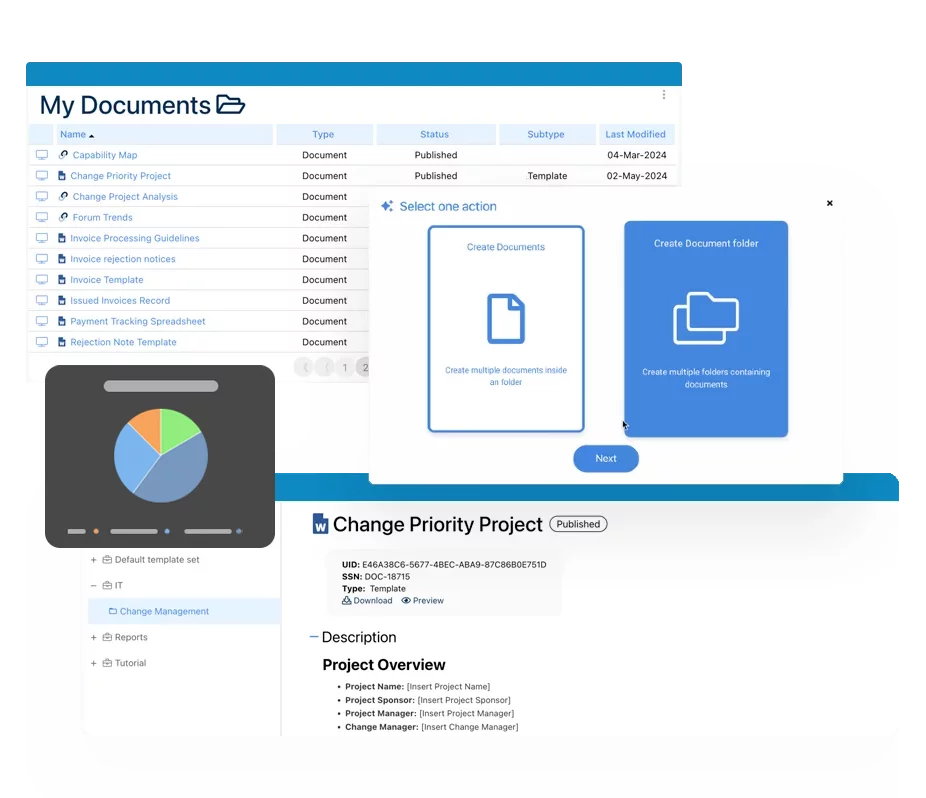 Elektronisches Qualitätsmanagementsystem (QMS)
Elektronisches Qualitätsmanagementsystem (QMS)- Überblick über das Qualitätsmanagementsystem
- Dokumente Control & Aufzeichnungen Mgmt
- Audit & Akkreditierung Mgmt
- Korrektur- und Präventivmaßnahmen
- Qualitätsereignis (nicht konform/konform), beschwerde, konformität
- Risikomanagement
- Management von Vorfällen
- Umwelt, Gesundheit und Sicherheit
- Produkt- und Lieferantenmanagement (SCAR)
- Ausbildung Management
- Control Management
- Aktionspunkte Management
- Management Review
- FMEA
- Pharmakovigilanz
- Data Migration und Integration
 Risk, Governance & Compliance (GRC)
Risk, Governance & Compliance (GRC)- Überblick zu Risiko, Governance & Compliance
- Risikomanagement und Kontrolle
- Einhaltung gesetzlicher Vorschriften
- Zusammenarbeit & Governance
- Data Migration und Integration
- Anbindung der Offline-App
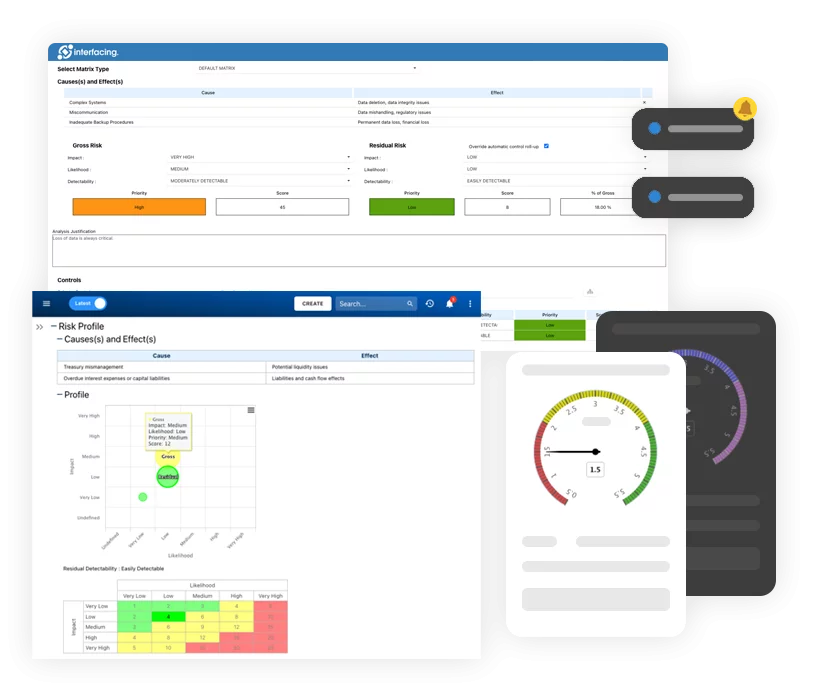 Schnelle Anwendungsentwicklung mit wenig Code (LC)
Schnelle Anwendungsentwicklung mit wenig Code (LC)- Low-Code-Automatisierungsplattform Übersicht
- Gestaltung elektronischer Webformulare (eFORMS)
- Low-Code-Automatisierungsplattform Übersicht
- Datenbank Tabelle Entity Designer
- Konzeption und Management von Aufgaben
- Entwurf und Verwaltung von BPMS-Anwendungen
- Integration mit externen Ressourcen und Anwendungen
- Definieren & Verwalten von Regeln/ Kontrollen/ Aktionen
- Elektronische Dienstleistungen
- Benutzer Startseite
- BAM (Business Activity Monitoring)
- Benutzerdefiniertes Dashboard-Design
- Data Migration und Integration
 Betriebliches Kontinuitätsmanagement (BCM)
Betriebliches Kontinuitätsmanagement (BCM)- BCM-Übersicht
- Analyse der geschäftlichen Auswirkungen
- Katastrophenschutz-Simulation
- Verwaltung der Handlungspunkte
- Verwaltung von Massenbenachrichtigungen
- Vermögensverwaltung
- Data Migration und Integration
 Unternehmensarchitektur (EA)
Unternehmensarchitektur (EA) Beratungsdienste
Interfacing ist hier, um Sie bei allen Transformationsinitiativen zu begleiten.
- Einhaltung gesetzlicher VorschriftenAnwendungsfälleLernzentrumRahmen & PraktikenEinhaltung gesetzlicher VorschriftenAnwendungsfälle
- Qualitätsmanagement-System (QMS)
- Digitale Transformation
- Kontinuierliche Verbesserung
- Governance, Risiko & Compliance
- Wissensmanagement
- Systemimplementierung (ERP, CRM…)
 Lernzentrum
Lernzentrum- Gemeinschaftsportal
- Webinare
- Videos
- Was ist BPM?
- BPMN 2.0-Symbolik
- Prozess-Mapping vs. Modellierung
- Glossar
 Rahmen & Praktiken
Rahmen & Praktiken - Über unsKundenerfolgPartnerÜber unsKundenerfolgPartner



Biowissenschaften (Lifescience) und Pharmazeutik
Please Select contact form.
Erfahren Sie, wie Interfacing dazu beitragen kann, Ihr GxP-Programm zu verbessern.

Qualitätsmanagementsoftware für Pharma-Unternehmen
Jeder Aspekt des pharmazeutischen Herstellungsprozesses muss gemäß den GxP-Anforderungen gesteuert und überwacht werden. Um die Integrität des Unternehmens zu gewährleisten und die Qualitätssicherung aufrechtzuerhalten, muss die Umsetzung von Standards wie ISO 9000 verfolgt werden. Dies bedeutet, dass effizient gestaltete Prozesse während des gesamten Betriebs von der Produktentwicklung über die Lieferkette bis hin zum Versand installiert werden müssen. Durch die Einführung einer starken, prozessorientierten Kultur kann Ihr Unternehmen reibungslos von chaotischen und Ad-hoc-Managementsystemen zu einem reibungslosen und gewinnbringenden Betrieb übergehen.
Eine Lösung, die auf die Bedürfnisse der
Biowissenschaften und pharmazeutische Industrie
Die Enterprise Process Center© Suite, die Lösung von Interfacing zur Prozessoptimierung und -automatisierung, zur Digitalisierung der SOP-Dokumentation und zur proaktiven Überwachung von Vorschriften, hat zu erheblichen Zeiteinsparungen durch eine beschleunigte Genehmigung und Validierung, eine verbesserte Sichtbarkeit und betriebliche Verbesserungen für Kunden wie die folgenden geführt:
Ende-zu-Ende-Ausrichtung
Ende-zu-Ende-Ausrichtung
Der EPC ermöglicht es Unternehmen der Biowissenschaften, Abteilungen, Vorschriften, Verfahren und Kontrollen in einem einzigen Repository zusammenzuführen, um schnelle und standardisierte kontinuierliche Verbesserungen zu ermöglichen. Unsere Technologie ermöglicht die Fragmentierung von Informationen, um wiederverwendbare Datenfragmente zu erstellen.
Beschleunigte Genehmigungen und Validierung
Beschleunigte Genehmigungen und Validierung
Die Schnittstellenlösung für QMS bietet nachhaltige Zeitersparnis durch reduzierte Schulungs-, Aktualisierungs- und Umschulungszeiten. Der integrierte Genehmigungs-, Überprüfungs- und Anerkennungs-Workflow trägt auch dazu bei, die Validierung neuer Versionen von Standardarbeitsanweisungen (SOPs) durch fragmentierte inhaltliche Überprüfungs- und Genehmigungszyklen zu rationalisieren und die Entscheidungsfindung zu erleichtern.
Digitale Signatur und Multi-Faktor-Authentifizierung
Digitale Signatur und Multi-Faktor-Authentifizierung
EPC erfüllt die sehr strengen Anforderungen, die mit der Einhaltung von FSA QSR, ISO 13845 und GxP-Programmen verbunden sind, und alle SOPs und Prozesse werden analysiert und dokumentiert, wobei die Prüfprotokolle die Einhaltung von 21 CFR Part 11 oder Anhang 11 Electronic Record and Electronic Signature (ERES) und eine Vielzahl anderer gesetzlicher Anforderungen durch RSA-Verschlüsselung, Tresorschlüsselgeschichte und Multi-Faktor-Authentifizierung (MFA) gewährleisten
Verbesserte Geschwindigkeit und Agilität
Verbesserte Geschwindigkeit und Agilität
Die Enterprise Process Center© Suite von Interfacing ist vollständig mobil und digital und bietet Life-Science-Organisationen die Flexibilität einer Qualitätsdokumentation, die über eine Vielzahl von Medien wie Telefon, Tablets, Grafik und Text einsehbar ist, um die Agilität und Selbstschulung der Mitarbeiter zu fördern.
Unterstützung mehrerer Sprachen
Unterstützung mehrerer Sprachen
Die Enterprise Process Center© Suite von Interfacing bietet aufschlussreiche Möglichkeiten zur Verwaltung globaler Inhalte, sei es durch automatische Übersetzungsvorschläge für alle Inhaltsfragmente oder die Möglichkeit, Abweichungen für SOPs nach Land, Region oder Produkttyp zu sammeln.
Gute pharmazeutische Herstellungspraktiken (GMP)
Wir wissen, dass die Anforderungen, die an pharmazeutische Unternehmen in Bezug auf die Einhaltung der Vorschriften gestellt werden, sehr hoch sind und dass GxP ein wesentlicher Bestandteil dieses Programms ist. Durch den Einsatz unserer Lösungen gewinnt Ihr Unternehmen die Verantwortlichkeit und Konsistenz, die Ihnen einen Wettbewerbsvorteil gegenüber Ihrer Konkurrenz verschaffen. Unsere Tools gewährleisten volle Transparenz von Anfang bis Ende, von der Erstellung und Änderung einer Verordnung über die Genehmigung und Überarbeitung des Inhalts bis hin zur Aktualisierung und Umschulung der Mitarbeiter für Standardarbeitsanweisungen (SOPs). Wir sehen das gesamte Lebenszyklusmanagement als bewegliche Teile eines kompletten Ökosystems und deshalb sind wir ein einzigartiger Ansatz, der regulatorische Anforderungen, Dokumente, Prozesse, Arbeitsanweisungen und Governance kombiniert.
GxP-Konformität
Unser Ansatz kann bei allen Regulierungen und Compliance-Anforderungen im Zusammenhang mit der Pharmaproduktion und medizinischen Geräten helfen (GxP, CFR, GCP, GLP, GMP, HIPAA, ISO9001, Vorschriften für medizinische Geräte, SOX, BITS, CSA, FDA, FedRAMP, FIPS, FISMA, MHRA, NISP DoD, PCI DSS, SOC 2, U.S. SEC 17a-4 u.a.).
Inhalte verwalten
Verwalten Sie die einzelnen Informationen, weisen Sie Eigentümer zu und stellen Sie die Governance durch Genehmigungszyklen und Änderungsanfragen sicher.
Digitale Signatur
We fully support digital signature to ensure that the audit trail of all content is secure, time-stamped, with accurate and complete copies of records available for inspection throughout the retention period.
Transparenz sicherstellen
Vollständige Sichtbarkeit, um zu verstehen, wo Datensätze verwendet werden und wie sie anwendbar sind. Sie können auch digitale Inhalte mit klarer Accountability pflegen, einschließlich Rollen und Verantwortlichkeiten.
Auswirkungsanalyse durchführen
Analysieren Sie Ihre Aufzeichnungen auf nachgelagerte Auswirkungen und analysieren Sie die potenziellen Auswirkungen auf Richtlinien, SOPs, Unternehmensbereiche und zugehörige Aufzeichnungen.
Digitale SOPs
Generieren Sie eine vollständige, anpassbare Ausgabe von Prozessen und zugehörigen Aufzeichnungen wie z. B. Regulierungen in einem druckfertigen und exportierbaren Word-Format. Sie müssen SOP nicht mehr auf Papier verwalten! Die digitale SOP ist die ganze Zeit synchronisiert.
Genehmigungs- und Governance-Workflow
Integrierte und eingebettete Genehmigungs-Workflows zur Gewährleistung einer strengen Kontrolle über die Änderung Ihrer Unterlagen, einschließlich der Validierung von Änderungen, der Bewertung von Auswirkungen und der Hervorhebung von Änderungen.
Förderung der Zusammenarbeit
Durch die Zusammenführung von Zielen und die Schaffung eines gemeinsamen Rahmens für Ihre Teams können diese strategisch zusammenarbeiten, Änderungsanforderungen erstellen und den Umsetzern Aufgaben zuweisen.
Engagement für Compliance
Im Rahmen unseres kontinuierlichen Engagements für Compliance und zur Unterstützung unserer Kunden bei der Einhaltung ihrer regulatorischen Anforderungen sind wir stets bestrebt, Wege zu finden, um unseren Kunden zu helfen, vollständige Compliance zu erreichen und aufrechtzuerhalten.
ISO 27001 Zertifizierung
Interfacing ist nach ISO 27001 zertifiziert, was unser Engagement für erstklassige Informationssicherheit und den Schutz von Kundendaten unterstreicht. Wir bieten eine sichere, konforme Umgebung, der unsere Kunden vertrauen können.
Partnerschaft mit AWS
Wir arbeiten mit Amazon Web Services (AWS) für das Cloud-Hosting zusammen, aufgrund ihrer bewährten Compliance-Standards. Die globalen Datenzentren von AWS erfüllen die Anforderungen von SOC 1 Typ II und ISO 27001. Weitere Informationen zur Compliance von AWS mit ISO 18345, FDA QSR und GxP finden Sie in ihrem Compliance-Programm.

Kostenlose Demo anfordern
Dokumentieren, analysieren, verbessern, digitalisieren und überwachen Sie Ihre Prozesse, Risiken, gesetzlichen Anforderungen und Leistungsindikatoren mit Interfacings integriertem Managementsystem Digital Twin, dem Enterprise Process Center®!




