- Gestión de Procesos de Negocio (BPM)Sistema de Gestión de Documentos (SGD)Sistema electrónico de gestión de la calidad (SGC)Riesgo, Gobernanza y Cumplimiento (GRC)Desarrollo rápido de aplicaciones de bajo código (LC)Gestión de la Continuidad de Negocio (BCM)Arquitectura Empresarial (EA)Gestión de Procesos de Negocio (BPM)
- Visión general de la gestión de procesos negocio
- Análisis, generación, análisis y mejora de procesos de IA
- Mapeo / Modelado de Procesos
- Análisis y mejora de procesos
- Simulación de procesos
- Minería de procesos
- Colaboración y gobernanza
- Data Migración e integración
- Aplicación offline de Interfacing
 Sistema de Gestión de Documentos (SGD)
Sistema de Gestión de Documentos (SGD)- Visión general del control de documentos
- Creación y mejora de contenidos de IA
- Gestión de políticas y procedimientos (PNT)
- Colaboración y gobernanza
- Data Migración e integración
- Aplicación offline de Interfacing
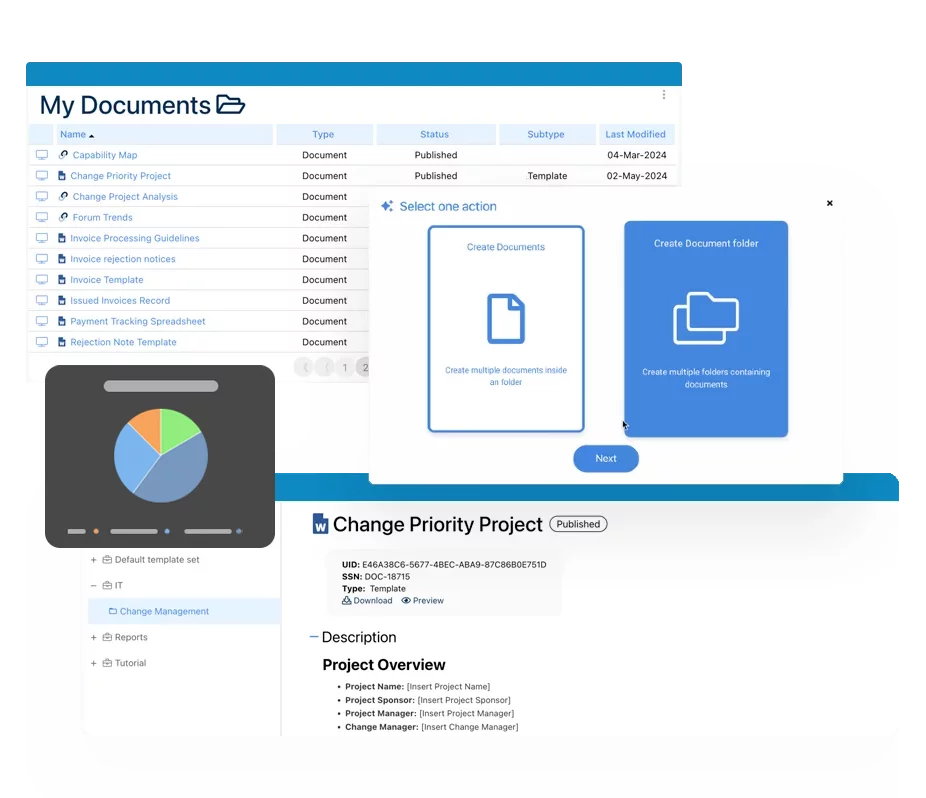 Sistema electrónico de gestión de la calidad (SGC)
Sistema electrónico de gestión de la calidad (SGC)- Visión general del sistema de gestión de la calidad
- Control de Documentos y gestión de Registros
- Gestión de Auditoría y Acreditación
- Acción correctiva y preventiva
- Evento de calidad (No conforme/Quejas, Conformidad)
- Gestión de riesgos
- Gestión de incidentes
- Salud y seguridad medioambiental
- Gestión de productos y proveedores (SCAR)
- Gestión de la formación
- Gestión del Control
- Gestión de elementos de acción
- Revisión de la gestión
- FMEA
- Farmacovigilancia
- Data Migración e integración
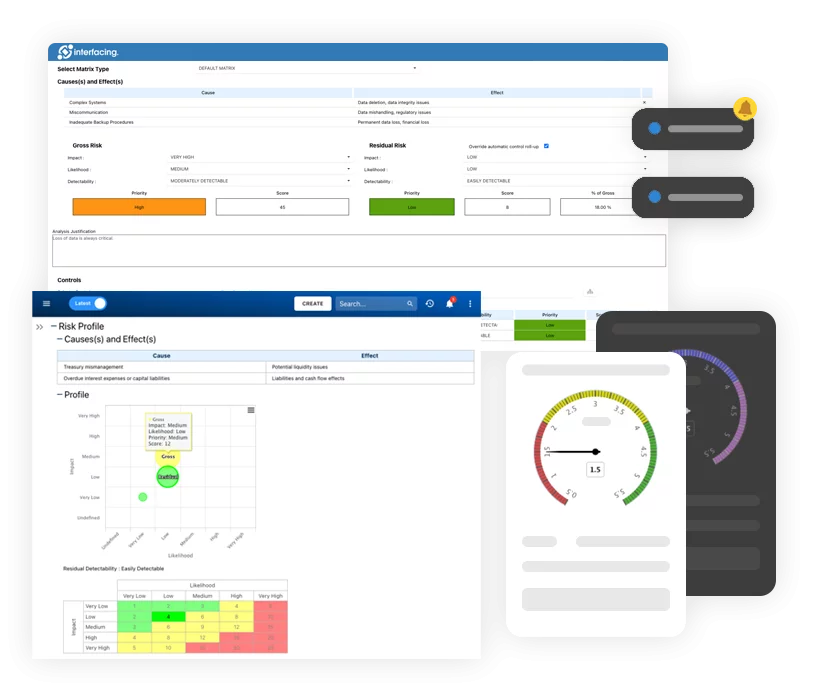
 Riesgo, Gobernanza y Cumplimiento (GRC)
Riesgo, Gobernanza y Cumplimiento (GRC)- Visión general de Riesgo, Gobernanza y Cumplimiento
- Gestión de riesgos y control
- Cumplimiento de la normativa
- Colaboración y gobernanza
- Data Migración e integración
- Aplicación offline de Interfacing
 Desarrollo rápido de aplicaciones de bajo código (LC)
Desarrollo rápido de aplicaciones de bajo código (LC)- Visión general de la plataforma de automatización Low Code
- Diseño de formularios web electrónicos (eFORMS)
- Visión general de la plataforma de automatización Low Code
- Diseñador de entidades de tabla de base de datos
- Diseñador de Integración de Sistemas
- Seguimiento y delegación de tareas
- Reglas/Guardias/Acciones personalizadas
- Servicios de mensajes de texto/voz
- BAM (Monitorización de la Actividad Empresarial)
- Data Migración e integración
 Gestión de la Continuidad de Negocio (BCM)
Gestión de la Continuidad de Negocio (BCM)- Visión general de BCM
- Análisis del impacto empresarial
- Planificación de la continuidad de la actividad
- Simulación de recuperación en caso de catástrofe
- Gestión de elementos de acción
- Gestión de notificaciones masivas
- Gestión de activos
- Data Migración e integración
 Arquitectura Empresarial (EA)
Arquitectura Empresarial (EA) Consulting Services
Interfacing está aquí para guiarle en cualquier iniciativa de transformación.
- IndustriasCumplimiento de la normativaCasos prácticosCentro de AprendizajeMarco y prácticasIndustrias
- Sanidad
- Tecnología de dispositivos médicos
- Ciencias de la vida, Farmacéutica
- Aeroespacial y Defensa
- Aerolíneas y aviación
- Medios de comunicación y telecomunicaciones
- Gobierno y Ejército
- Tecnología
- Energía
- Logística y Operaciones Portuarias
- Banca y mercados de capitales
- Comercio minorista y consumo
- Consulta
- Educación
- Ingeniería y construcción
- Fabricación
- Servicios financieros
- Seguros
- Productos químicos
Cumplimiento de la normativaCasos prácticosCentro de AprendizajeMarco y prácticas - Sobre nosotrosÉxito del clienteSociosSobre nosotrosÉxito del clienteSocios



Ciencias Biológicas y Farmacéutica
Please Select contact form.
Descubra cómo Interfacing puede ayudar a mejorar su programa de calidad digital GxP

Software de Gestión de Calidad Digital (QMS) para Ciencias Biológicas y Farmacéutica
Cada aspecto del proceso de fabricación farmacéutica debe ser controlado y monitoreado según los requisitos de GxP para las organizaciones farmacéuticas, de dispositivos médicos y de ciencias biológicas.
Con el fin de garantizar la integridad de la empresa y mantener el aseguramiento de la calidad, se debe llevar a cabo la implementación de normas como la ISO 9000. Esto significa instalar procesos diseñados de manera eficiente en toda la operación, desde el desarrollo de productos hasta la cadena de suministro y el envío. Al adoptar una cultura fuerte y centrada en los procesos, su empresa puede pasar sin problemas de sistemas de gestión caóticos y ad hoc a una operación de funcionamiento sin problemas que aumentará los beneficios.
Una solución diseñada para las necesidades de la industria farmacéutica y de ciencias biológicas.
Las principales empresas de ciencias biológicas se asociaron con Interfacing para implementar soluciones de flujo de trabajo que implican la gestión y automatización de procesos de negocio punto a punto. Esto incluye procesos de laboratorio, fabricación, administrativos, de productos y relacionados con el paciente.
La optimización y automatización de procesos de Interfacing, la digitalización de la documentación SOP, la solución de vigilancia regulatoria proactiva, y Enterprise Process Center © Suite han generado importantes ahorros de tiempo con aprobación y validación aceleradas, visibilidad mejorada y mejoras operativas para los clientes, que incluyen lo siguiente:
Alineación de extremo a extremo – Fuente única de la verdad
Alineación de extremo a extremo – Fuente única de la verdad
El EPC permite a las organizaciones de ciencias biológicas alinear fácilmente departamentos, regulaciones, procedimientos, controles, dentro de un único repositorio para permitir mejoras continuas rápidas y estandarizadas. Nuestra tecnología permite la fragmentación de la información para crear fragmentos de datos reutilizables.
Aprobaciones y validación aceleradas
Aprobaciones y validación aceleradas
Interfacing y la solución QMS ofrece un ahorro de tiempo sostenido al reducir el tiempo de entrenamiento, actualización y re-entrenamiento. El flujo de trabajo integrado de aprobación, revisión y aprobación también ayuda a agilizar la validación de la nueva versión de los procedimientos operativos estándar (SOP) a través de ciclos fragmentados de revisión y aprobación de contenido para ayudar a la toma de decisiones.
Firma digital y autenticación multifactor
Firma digital y autenticación multifactor
EPC cumple con los requisitos muy estrictos asociados con el cumplimiento de los programas GxP. Todos los SOPs y procesos se analizan y documentan, proporcionando así que los seguimientos de auditoría cumplen con el cumplimiento de 21 CFR Parte 11 Registro Electrónico y Firma Electrónica (ERES) y una serie de otros requisitos reglamentarios a través del cifrado RSA, la historia clave de la bóveda y la autenticación multifactor (MFA)
Velocidad y agilidad mejoradas
Velocidad y agilidad mejoradas
Enterprise Process Center© Suite es totalmente móvil y digital, proporcionando a la organización de ciencias biológicas la flexibilidad de la documentación de calidad fácilmente visible a través de una variedad de medios que incluyen teléfono, tabletas, gráfico y textual para aumentar la agilidad de los empleados y la auto-formación.
Soporte multi-idioma, traducción automática y contenido localizado
Soporte multi-idioma, traducción automática y contenido localizado
Enterprise Process Center© Suite de Interfacing proporciona formas perspicaces de administrar el contenido global, ya sea mediante sugerencias de traducción automatizadas para todos los fragmentos de contenido, o la capacidad de recopilar varianza para los SOP por país, región o tipo de producto
Las empresas de ciencias biológicas y farmacéuticas confían en Interfacing para proporcionar la mejor solución de su clase para administrar su contenido de calidad, datos y flujos de trabajo teniendo en cuenta la escalabilidad y la seguridad. Mediante la implementación de Enterprise Process Center de Interfacing© Suite, las empresas de ciencias biológicas y farmacéuticas en todo el mundo, han optimizado su sistema de gestión de calidad, han aumentado su gestión regulatoria de datos digitales, al tiempo que han aprovechado las visualizaciones de contenido de calidad específicas del usuario y los modelos inteligentes de impacto y evaluación posteriores.
Buenas Prácticas farmacéuticas de fabricación
Entendemos que los requisitos que se imponen a las compañías farmacéuticas en términos de cumplimiento son muy altos y que GxP es una parte esencial de ese programa. Al utilizar nuestras soluciones, su empresa obtiene la responsabilidad y la coherencia que le brindarán una ventaja sobre la competencia. Nuestras herramientas garantizan una visibilidad completa de extremo a extremo, desde la creación y modificación de un reglamento hasta la aprobación y revisión del contenido hasta la actualización y readaptación de los empleados para los procedimientos operativos estándar (SOP). Vemos la administración completa del ciclo de vida como partes móviles de un ecosistema completo y es por eso que son un enfoque único que combina los requisitos reglamentarios, documentos, procesos, instrucciones de trabajo y gobernanza.
Cumplimiento de GxP
Nuestro enfoque puede ayudar con todas las regulaciones y cumplimientos relacionados con la producción farmacéutica y dispositivos médicos (GxP, CFR, GCP, GLP, GMP, HIPAA, ISO9001, regulaciones de dispositivos médicos, SOX, BITS, CSA, FDA, FedRAMP, FIPS, FISMA, MHRA, NISP DoD, PCI DSS, SOC 2, U.S. SEC 17a-4 entre otros).
Administrar contenido
Gestione los elementos individuales de información, asigne propietarios y garantice la gobernanza a través de ciclos de aprobación y solicitudes de cambio.
Firma digital
Admitimos plenamente la firma digital para garantizar que la pista de auditoría de todo el contenido sea segura, con marca de tiempo, con copias precisas y completas de los registros disponibles para su inspección durante todo el período de retención.
Garantizar la transparencia
Visibilidad completa para comprender dónde se utilizan los registros y su aplicabilidad. También puede mantener contenido digital con una clara rendición de cuentas, incluidos roles y responsabilidades.
Realizar análisis de impacto
Analice sus registros en busca de impactos posteriores y analice los posibles impactos en políticas, SOP, unidades de negocio y registros relacionados.
SOP digitales
Genere una salida personalizable completa de procesos y registros relacionados, como regulaciones en un formato Word listo para imprimir y exportar. ¡Ya no necesita administrar SOP en papel! El SOP digital está sincronizado todo el tiempo.
Flujo de trabajo de aprobación y gobernanza
Flujos de trabajo de aprobación integrados e integrados para garantizar un control estricto sobre el cambio de los registros, incluida la validación de cambios, la evaluación de impactos y el resaltado de los cambios.
Fomentar la colaboración
Al unir objetivos y crear un marco común para sus equipos, podrán cooperar estratégicamente, crear solicitudes de cambio y asignar tareas a los implementadores.
Compromiso con el Cumplimiento
Como parte de nuestro compromiso continuo con el cumplimiento y para ayudar a nuestros clientes a cumplir con sus requisitos regulatorios, siempre estamos buscando maneras de ayudar a nuestros clientes a alcanzar y mantener el cumplimiento total.
Certificación ISO 27001
Interfacing está certificado en ISO 27001, lo que demuestra nuestro compromiso con la seguridad de la información de primer nivel y la protección de los datos de nuestros clientes. Proporcionamos un entorno seguro y conforme en el que nuestros clientes pueden confiar.
Asociación con AWS
Nos asociamos con Amazon Web Services (AWS) para el alojamiento en la nube debido a sus estándares de cumplimiento probados. Los centros de datos globales de AWS cumplen con SOC 1 Tipo II e ISO 27001. Para obtener más detalles sobre su cumplimiento con ISO 18345, FDA QSR y GxP, consulte su programa de cumplimiento.
Asociaciones sanitarias recientes









