- Gestion des processus d'entreprise (BPM)Système de gestion des documents (SGD)Système électronique de gestion de la qualité (QMS)Risque, gouvernance et conformité (GRC)Développement rapide d'applications à faible code (LC)Gestion de la continuité des activités (BCM)Architecture d'entreprise (EA)Gestion des processus d'entreprise (BPM)
- Vue d’ensemble de la gestion des processus d’entreprise
- Analyse, génération, amélioration et exploration des processus par l’intelligence artificielle
- Cartographie / modélisation des processus
- Analyse et amélioration des processus
- Simulation des processus
- Exploration de processus/process mining
- Collaboration et gouvernance
- Migration et intégration des données
- Application hors-ligne d’Interfacing
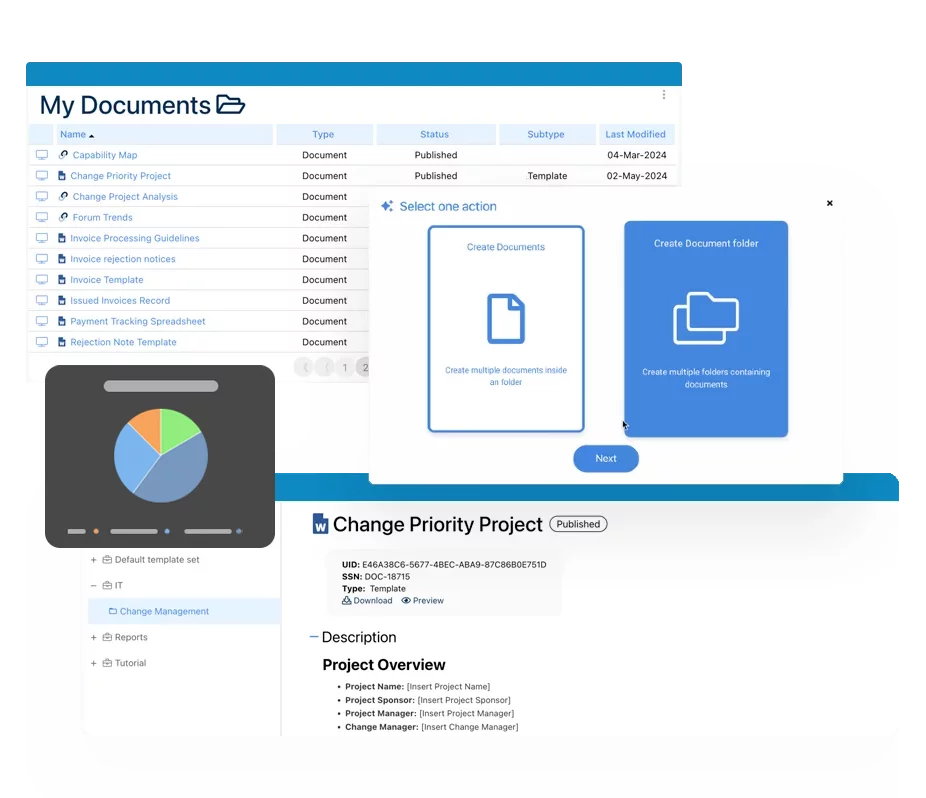
 Système de gestion des documents (SGD)
Système de gestion des documents (SGD)- Vue d’ensemble du contrôle des documents
- Création et amélioration du contenu avec l’intelligence artificielle
- Gestion des politiques et procédures (SOP)
- Parseur d’extraction de contenu de documents
- Collaboration et gouvernance
- Migration et intégration des données
- Application hors-ligne d’Interfacing
 Système électronique de gestion de la qualité (QMS)
Système électronique de gestion de la qualité (QMS)- Vue d’ensemble du système de gestion de la qualité
- Contrôle des documents et gestion des archives
- Gestion de l’audit et de l’accréditation
- Action corrective et préventive
- Événement de qualité (Non-conformité/plaintes/conformité)
- Gestion des risques
- Gestion des incidents
- Santé et sécurité environnementales
- Gestion des produits et des fournisseurs (SCAR)
- Gestion de la formation
- Gestion du contrôle
- Gestion des actions
- Examen de la gestion
- AMDE
- Pharmacovigilance
- Migration et intégration des données
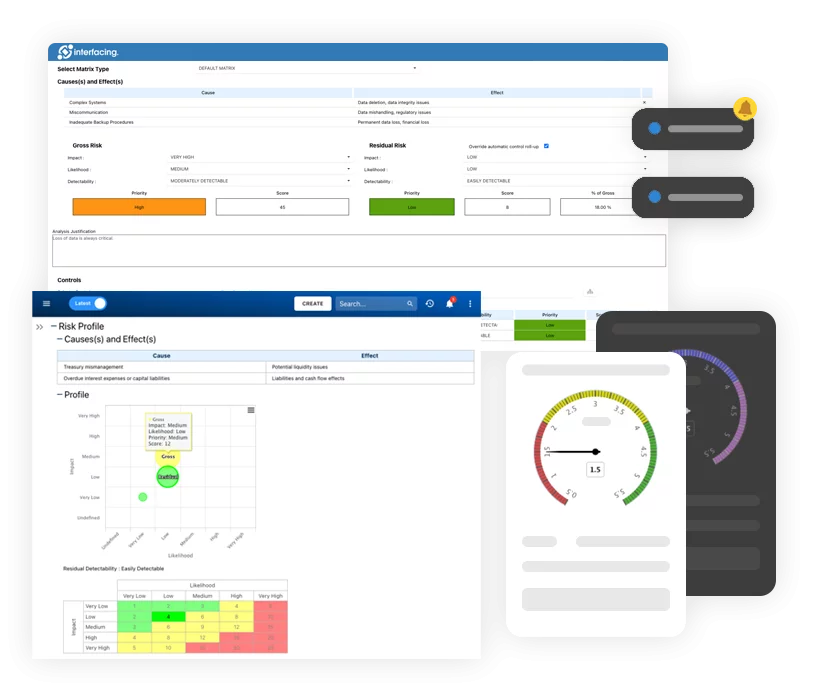
 Risque, gouvernance et conformité (GRC)
Risque, gouvernance et conformité (GRC)- Vue d’ensemble de la gestion des risques, de la gouvernance et de la conformité
- Gestion des risques et des contrôles
- Collaboration et gouvernance
- Migration et intégration des données
- Application hors-ligne d’Interfacing
 Développement rapide d'applications à faible code (LC)
Développement rapide d'applications à faible code (LC)- Vue d’ensemble de la plateforme d’automatisation à faible code
- Conception de formulaires électroniques (eFORMS)
- Concepteur d’entité de table de base de données
- Concepteur de l’intégration des systèmes
- Conception et gestion des tâches
- Règles, gardes et actions personnalisées
- Services de messagerie textuelle et vocale
- BAM (Business Activity Monitoring)
- Conception d’un tableau de bord personnalisé
- Migration et intégration de données
 Gestion de la continuité des activités (BCM)
Gestion de la continuité des activités (BCM)- Vue d’ensemble de la gestion de la continuité des activités
- Analyse d’impact sur les affaires
- Simulation de reprise après sinistre
- Gestion des actions
- Gestion des notifications de masse
- Gestion des actifs
- Migration et intégration des données
 Architecture d'entreprise (EA)
Architecture d'entreprise (EA) - Les industriesConformité réglementaireCas d'utilisationCentre d'apprentissageCadre et pratiquesLes industries
- Santé
- Technologies médicales
- Pharmaceutique
- Aérospace et Défense
- Aériennes et Aviation
- Médias et Télécommunications
- Gouvernemental et Militaire
- Technologie
- Énergie
- Opérations logistiques et portuaires
- Banque et marchés de capitaux
- Commerce de détail et consommation
- Services de Consultation
- Éducation
- Ingénierie et construction
- Fabrication
- Services Financiers
- Assurance
- Produits Chimiques
Conformité réglementaireCas d'utilisationCentre d'apprentissageCadre et pratiques - À propos de nousSuccès clientProgramme de partenariatÀ propos de nousSuccès clientProgramme de partenariat



Conformité à la norme 21 CFR Part 820 pour les dispositifs médicaux
Please Select contact form.
Assurez-vous que la conception, la production et la surveillance post-commercialisation sont conformes à la FDA grâce à des systèmes qualité propulsés par l’IA.

Qu’est-ce que la norme 21 CFR Part 820?
La norme 21 CFR Part 820, également connue sous le nom de Quality System Regulation (QSR), est un règlement de la Food and Drug Administration (FDA) des États-Unis qui définit les Bonnes Pratiques de Fabrication (CGMP) applicables aux fabricants de dispositifs médicaux. Ces règles régissent la conception, le contrôle et la traçabilité des dispositifs afin de garantir leur sécurité et leur efficacité tout au long de leur cycle de vie.
Introduit initialement en 1996 et mis à jour pour s’aligner avec la norme ISO 13485:2016, ce règlement constitue la pierre angulaire de la conformité FDA pour les dispositifs médicaux de classe I, II et III commercialisés aux États-Unis.
How AI Is Transforming ISO 13485 Compliance
Manual compliance management is slow, error-prone, and costly. AI helps organizations not just meet compliance—but stay ahead of it.
Here’s how AI accelerates ISO 13485 compliance:
- AI-powered process mining detects bottlenecks in QMS workflows.
- Natural language processing extracts insights from audit reports, nonconformance records, and supplier documents.
- Predictive analytics flag high-risk deviations and prevent regulatory issues.
- Smart forms and dynamic workflows streamline document control, training records, and SOP approvals.
By embedding AI into compliance frameworks, companies improve audit readiness, reduce manual errors, and stay aligned with evolving regulations.


Pourquoi est-ce nécessaire?
La norme 21 CFR Part 820 vise à minimiser les rappels de produits, les événements indésirables et les manquements réglementaires dans l’un des secteurs les plus réglementés au monde. Sans conformité, les entreprises s’exposent à des lettres d’avertissement, à des saisies de produits et à des interdictions d’importation.
Au-delà des exigences légales, le respect du QSR favorise un environnement structuré de perfectionnement continu, renforçant ainsi la sécurité des patients et la continuité des activités.


Who Needs to Comply with ISO 13485?
ISO 13485 applies to a broad set of organizations across the medical device supply chain:
- Original Equipment Manufacturers (OEMs)
- Suppliers of components and materials
- Contract sterilization and packaging services
- Developers of software used as a medical device (SaMD)
- Regulatory consultants and authorized representatives

Cas d’utilisation dans le monde réel
L’entreprise :
MedSense Diagnostics – une startup qui produit des patchs de surveillance ECG alimentés par l’IA.
Défi :
Suite à l’expansion du marché aux États-Unis, MedSense a reçu un formulaire 483 citant une mauvaise documentation de la validation du logiciel et la non-conformité des procédures de contrôle de la conception. L’inspection a révélé l’absence de liens entre les besoins des clients et les données de conception, ainsi que des analyses de risque incohérentes pour les mises à jour des microprogrammes.
Solution :
MedSense s’est associé à Interfacing pour déployer un système de gestion de la qualité numérique de bout en bout à l’aide de la plateforme EPC.
Des outils de cartographie des processus ont été utilisés pour retracer chaque étape du processus de conception et de changement.
Des robots d’audit dotés d’une intelligence artificielle ont repéré les validations manquantes et les fichiers de données de santé incomplets.
Les flux de travail CAPA ont été intégrés directement dans les documents SOP, garantissant que les déviations déclenchent des flux de travail instantanés sur la cause première.
Des tableaux de bord de formation ont permis de faire correspondre les responsabilités des membres de l’équipe à leurs dernières certifications.
Résultat :
En l’espace de six mois, l’entreprise a clos toutes les observations de la FDA, mis sur le marché deux nouvelles références et obtenu un financement de série B, démontrant ainsi que la conformité n’est pas un obstacle mais un catalyseur pour l’entreprise.
Secteurs d’activité concernés
Bien que le règlement 21 CFR Part 820 soit axé sur les dispositifs médicaux, sa portée s’étend bien au-delà des fabricants traditionnels. La conformité concerne un large écosystème d’entreprises impliquées dans la conception, l’assemblage, les logiciels et la logistique dans la chaîne de valeur des soins de santé.
Fabricants de dispositifs médicaux: Toute entreprise produisant des dispositifs de classe I, II ou III destinés à être utilisés pour le diagnostic, le traitement ou la prévention doit s’y conformer. Cela va des seringues aux stimulateurs cardiaques.
Fabricants sous contrat (CMO) : Qu’ils produisent des composants ou des dispositifs complets, les fabricants tiers doivent respecter les mêmes obligations de qualité que les OEM. De nombreux OEM tiennent les CMO contractuellement responsables du respect des QSR.
Software as a Medical Device (SaMD): les entreprises qui développent des logiciels de diagnostic autonomes, tels que des analyses d’imagerie basées sur l’IA ou des applications mobiles de suivi de la santé, sont de plus en plus ciblées par les autorités de réglementation en vertu de la partie 820.
Diagnostics in vitro (DIV): Les kits de tests sanguins, les machines PCR et les instruments de laboratoire doivent être conformes aux contrôles de conception et aux mandats CAPA (actions correctives et préventives).
Développeurs de produits combinés: Les dispositifs qui intègrent des produits biologiques ou pharmaceutiques (par exemple, les seringues pré-remplies, les implants d’administration de médicaments) sont soumis à une double surveillance de la part des services de la FDA chargés des dispositifs et des médicaments.
Distributeurs et importateurs mondiaux: Même ceux qui ne s’occupent que de la logistique ou de l’entreposage peuvent faire l’objet d’une inspection s’ils étiquettent ou reconditionnent des appareils.
L’écosystème est complexe, mais l’alignement sur le 21 CFR Part 820 permet d’instaurer la confiance avec les régulateurs, les payeurs et les prestataires de soins de santé.

Étapes vers la conformité / Préparation à l’inspection
Bien que la FDA ne délivre pas de « certification », les entreprises doivent maintenir un état constant de préparation à l’inspection. Ce parcours exige une maturité opérationnelle, un contrôle rigoureux des processus et une gouvernance numérique. Voici une feuille de route complète :
-
Analyse des écarts et hiérarchisation des risques
Utilisez des outils d’audit alimentés par l’IA pour comparer votre SGQ aux sous-parties de la norme 21 CFR Part 820 (contrôles de conception, contrôle de la production et des procédés, enregistrements, etc.). La plateforme EPC d’Interfacing identifie les non-conformités et les classe selon leur niveau de risque, permettant des plans correctifs fondés sur les données. -
Définition de la portée
Délimitez clairement la portée de votre SGQ : sites, dispositifs et fournisseurs concernés. Cela influencera la documentation de vos processus, l’attribution des rôles et la structuration des audits. Avec Interfacing, les organisations peuvent cartographier visuellement leurs opérations multi-sites pour un alignement conforme à leur structure d’entreprise. -
Contrôle de la conception et de la documentation
Mettez en place des contrôles rigoureux sur la planification, les entrées, les sorties et la vérification de la conception. Les outils d’IA peuvent suggérer les liens manquants dans les matrices de traçabilité ou signaler les incohérences dans les évaluations des risques. EPC centralise la documentation et applique des signatures numériques traçables. -
Formation, rôles et responsabilisation
Assignez les rôles de conformité et assurez la formation adéquate des employés. De nombreuses lettres d’avertissement de la FDA relèvent l’absence de documentation de formation. Interfacing permet la création de parcours d’apprentissage automatisés et des tableaux de bord qui signalent les écarts de compétences avant les audits. -
Audits internes et simulations d’inspection
Planifiez des audits internes pour chaque section du QSR. Utilisez des analyses pour détecter les écarts aux procédures et anticiper les résultats d’audit. L’assistant d’audit IA d’Interfacing simule les questions de la FDA, génère des CAPA intelligentes et prépare des rapports pour les organismes réglementaires. -
Inspection FDA / Évaluation MDSAP
Préparez-vous aux constats du formulaire 483 de la FDA à l’aide de tableaux de bord en direct, de l’escalade automatisée des CAPA et de journaux d’audit prêts à l’exportation. L’accès en temps réel aux documents et les signatures électroniques permettent de gagner un temps précieux lors des inspections sur site.

Pièges fréquents à éviter
Atteindre la conformité ne consiste pas uniquement à mettre en place des politiques : il s’agit d’assurer la traçabilité, la responsabilisation et l’adaptabilité sous contrôle réglementaire. Voici des problématiques souvent négligées qui entraînent des échecs de conformité :
Dossiers de conception incomplets ou fragmentés (DHFs)
Les Dossiers d’Historique de Conception doivent raconter une histoire complète et cohérente de l’évolution du dispositif, du concept à la mise en marché. Une documentation manquante ou un mauvais contrôle des versions peut invalider votre calendrier de développement. Le module de gouvernance documentaire d’Interfacing assure une conformité prête pour l’audit avec historique des révisions et protocoles de validation liés.
Contrôle insuffisant des fournisseurs
Même si votre SGQ interne est solide, une défaillance chez un fournisseur peut entraîner de graves manquements à la conformité. La FDA exige des qualifications, audits et contrôles documentés pour les fournisseurs. Interfacing automatise ces tâches grâce à une notation numérique des fournisseurs, des tableaux de bord de performance et l’intégration du cycle de vie contractuel.
CAPA réactif plutôt que préventif
Trop d’entreprises n’agissent qu’après la survenue d’un écart. Les analyses prédictives d’Interfacing identifient les défaillances émergentes de manière proactive, transformant votre système qualité en environnement préventif.
Systèmes de formation et RH cloisonnés
Des systèmes déconnectés entraînent des écarts entre les rôles et les dossiers de formation. Interfacing propose des matrices IA d’adéquation poste-formation avec alertes d’expiration automatisées et règles d’escalade.
Absence de surveillance des risques en temps réel
Des évaluations de risques statiques ne suffisent plus aux auditeurs. La plateforme EPC prend en charge des registres de risques dynamiques mis à jour par des déclencheurs événementiels (ex. : pics de plaintes, constats d’audit), offrant à la direction une vue en temps réel de l’exposition opérationnelle.
Comment l’intelligence artificielle améliore la conformité au SMQ
L’IA transforme la conformité traditionnelle en une gouvernance proactive de la qualité. Les principales applications de l’IA dans le cadre du 21 CFR Part 820 sont les suivantes :
Contrôle intelligent des documents : Automatisez la gestion des versions, l’approbation des modifications et les journaux d’accès grâce à la numérisation en langage naturel et à la traçabilité.
Conformité prédictive : L’IA identifie les modèles de risque en analysant les déviations, les résultats d’audit ou les tendances des plaintes avant qu’elles ne s’aggravent.
Automatisation de la conformité des formations : L’IA évalue les taux d’achèvement des formations par rôle, signale les certifications en retard et inscrit automatiquement les employés à la recertification.
Gestion intelligente des CAPA : Les suggestions de causes profondes basées sur les cas antérieurs et l’historique des écarts accélèrent l’efficacité des corrections.
Intelligence réglementaire : Des robots alimentés par NLP analysent les nouvelles directives de la FDA et génèrent des alertes sur l’impact de la conformité, adaptées à la structure de votre système de gestion de la qualité.
Interfacing apporte l’IA à chaque couche de votre opération de conformité, offrant un avantage à l’épreuve du temps.
Comment Interfacing peut vous aider
Interfacing Technologies Corporation a aidé certaines des entreprises les plus réglementées au monde à réaliser la transformation numérique en conformité. Pour les entreprises de dispositifs médicaux visant à se conformer à la norme 21 CFR Part 820, nous proposons :
Conception visuelle des processus
Modélisez et optimisez les processus du SMQ à l’aide d’outils intuitifs de type « glisser-déposer » qui correspondent aux attentes de la FDA.Outils automatisés d’audit et de CAPA
Répondez plus rapidement aux déviations grâce à des flux de travail qui guident les utilisateurs à travers les étapes de la cause première, du confinement et de la vérification.SGQ centralisé avec support AI
Unifiez les procédures opératoires normalisées, les formulaires, les enregistrements et la formation dans un environnement contrôlé, accessible à tous vos sites internationaux.Tableaux de bord en temps réel
Surveillez l’état de préparation à l’audit, l’expiration des documents, la conformité des employés et les performances des fournisseurs à partir d’une interface unique.
Notre plateforme ne se contente pas de vous aider à respecter la conformité, elle vous aide à la faire évoluer.

Ensure Process & Quality Governance
Interfacing’s Enterprise Process Center® (EPC) allows you to define, document, and enforce ISO 9001 quality controls organization-wide. Policies, procedures, and SOPs are directly tied to processes and roles—ensuring your QMS is embedded in everyday operations with full transparency. .

Eliminate Manual Errors with AI-Driven QMS
Standardizing documentation and workflows within EPC removes the need for spreadsheets and disconnected systems. Our AI flags outdated procedures, suggests process improvements, and helps maintain version control—reducing the risk of non-compliance and audit issues.

Gain Full Audit Readiness & Traceability
EPC provides real-time traceability across all quality processes—from document approvals to CAPA workflows. With automated audit trails and visual process maps, you’re always ready for certification audits and internal reviews, no last-minute scrambling required

Improve Operational Efficiency Without Sacrificing Compliance
Interfacing’s QMS automates routine tasks such as change control, training sign-offs, and document updates. This not only frees up valuable staff time, but also ensures consistent adherence to ISO 9001 guidelines across all departments and geographies.

Reduce the Cost of Quality Compliance
With centralized process governance and AI-enhanced workflows, EPC reduces the overhead of maintaining your QMS. From smarter audit prep to fewer non-conformities, organizations save time, cut errors, and accelerate their path to ISO 9001 certification.

Build a Culture of Continuous Improvement
ISO 9001 is about more than passing audits—it’s about evolving your organization. Interfacing’s platform helps identify quality gaps, track corrective actions, and promote ongoing learning and accountability—turning compliance into a competitive advantage.
Pourquoi choisir Interfacing?
Avec plus de deux décennies de logiciels d'IA, de qualité, de processus et de conformité, Interfacing continue d'être un leader dans l'industrie. À ce jour, nous avons servi plus de 500+ entreprises de classe mondiale et des sociétés de conseil en gestion de toutes les industries et de tous les secteurs. Nous continuons à fournir des solutions numériques, cloud et IA qui permettent aux organisations d'améliorer, de contrôler et de moderniser leurs processus tout en allégeant le fardeau de la conformité réglementaire et des programmes de gestion de la qualité.
Pour en savoir plus ou discuter de la manière dont Interfacing peut aider votre organisation, veuillez remplir le formulaire ci-dessous.

Documentation : Piloter la transformation, la gouvernance et le contrôle
• Obtenez des informations complètes et en temps réel sur vos opérations.
• Améliorez la gouvernance, l'efficacité et la conformité.
• Assurez une conformité fluide avec les normes réglementaires.

eQMS : Automatiser les workflows de qualité et de conformité & rapports
• Simplifiez la gestion de la qualité avec des workflows automatisés et une traçabilité continue.
• Standardisez la gestion des CAPA, des audits fournisseurs, de la formation et des workflows associés.
• Transformez la documentation en informations exploitables pour la Qualité 4.0.

Développement rapide d'applications low-code : Accélérer la transformation numérique
• Créez rapidement des applications personnalisées et évolutives.
• Réduisez le temps et les coûts de développement.
• Adaptez-vous rapidement pour répondre aux besoins évolutifs des clients et de votre entreprise.
L’IA pour transformer votre entreprise !
Conçus pour optimiser les opérations, l'efficacité et renforcer la conformité. Découvrez nos solutions alimentés par l’IA :
• Répondre aux questions des employés.
• Transformer des vidéos en processus.
• Recommander des améliorations de processus et des impacts réglementaires.
• Générer des formulaire, processus, risques, réglementations, KPIs, et bien plus.
• Fragmenter les normes réglementaires

Demandez une démo gratuite
Documentez, analysez, améliorez, numérisez et surveillez vos processus, vos risques, vos exigences réglementaires et vos indicateurs de performance au sein du système de gestion intégré Digital Twin d’Interfacing, l’Enterprise Process Center®!
Approuvé par nos clients à travers le monde !
Plus de 400 entreprises de classe mondiale et cabinets de conseil en gestion.



















































INTEGRATION
Approuvé par les nos clients dans le monde entier !
Plus de 400 entreprises de classe mondiale et cabinets de conseil en gestion.




























