- Gestión de Procesos de Negocio (BPM)Sistema de Gestión de Documentos (SGD)Sistema electrónico de gestión de la calidad (SGC)Riesgo, Gobernanza y Cumplimiento (GRC)Desarrollo rápido de aplicaciones de bajo código (LC)Gestión de la Continuidad de Negocio (BCM)Arquitectura Empresarial (EA)Gestión de Procesos de Negocio (BPM)
- Visión general de la gestión de procesos negocio
- Análisis, generación, análisis y mejora de procesos de IA
- Mapeo / Modelado de Procesos
- Análisis y mejora de procesos
- Simulación de procesos
- Minería de procesos
- Colaboración y gobernanza
- Data Migración e integración
- Aplicación offline de Interfacing
 Sistema de Gestión de Documentos (SGD)
Sistema de Gestión de Documentos (SGD)- Visión general del control de documentos
- Creación y mejora de contenidos de IA
- Gestión de políticas y procedimientos (PNT)
- Colaboración y gobernanza
- Data Migración e integración
- Aplicación offline de Interfacing
 Sistema electrónico de gestión de la calidad (SGC)
Sistema electrónico de gestión de la calidad (SGC)- Visión general del sistema de gestión de la calidad
- Control de Documentos y gestión de Registros
- Gestión de Auditoría y Acreditación
- Acción correctiva y preventiva
- Evento de calidad (No conforme/Quejas, Conformidad)
- Gestión de riesgos
- Gestión de incidentes
- Salud y seguridad medioambiental
- Gestión de productos y proveedores (SCAR)
- Gestión de la formación
- Gestión del Control
- Gestión de elementos de acción
- Revisión de la gestión
- FMEA
- Farmacovigilancia
- Data Migración e integración
 Riesgo, Gobernanza y Cumplimiento (GRC)
Riesgo, Gobernanza y Cumplimiento (GRC)- Visión general de Riesgo, Gobernanza y Cumplimiento
- Gestión de riesgos y control
- Cumplimiento de la normativa
- Colaboración y gobernanza
- Data Migración e integración
- Aplicación offline de Interfacing
 Desarrollo rápido de aplicaciones de bajo código (LC)
Desarrollo rápido de aplicaciones de bajo código (LC)- Visión general de la plataforma de automatización Low Code
- Diseño de formularios web electrónicos (eFORMS)
- Visión general de la plataforma de automatización Low Code
- Diseñador de entidades de tabla de base de datos
- Diseñador de Integración de Sistemas
- Seguimiento y delegación de tareas
- Reglas/Guardias/Acciones personalizadas
- Servicios de mensajes de texto/voz
- BAM (Monitorización de la Actividad Empresarial)
- Data Migración e integración
 Gestión de la Continuidad de Negocio (BCM)
Gestión de la Continuidad de Negocio (BCM)- Visión general de BCM
- Análisis del impacto empresarial
- Planificación de la continuidad de la actividad
- Simulación de recuperación en caso de catástrofe
- Gestión de elementos de acción
- Gestión de notificaciones masivas
- Gestión de activos
- Data Migración e integración
 Arquitectura Empresarial (EA)
Arquitectura Empresarial (EA) Consulting Services
Interfacing está aquí para guiarle en cualquier iniciativa de transformación.
- IndustriasCumplimiento de la normativaCasos prácticosCentro de AprendizajeMarco y prácticasIndustrias
- Sanidad
- Tecnología de dispositivos médicos
- Ciencias de la vida, Farmacéutica
- Aeroespacial y Defensa
- Aerolíneas y aviación
- Medios de comunicación y telecomunicaciones
- Gobierno y Ejército
- Tecnología
- Energía
- Logística y Operaciones Portuarias
- Banca y mercados de capitales
- Comercio minorista y consumo
- Consulta
- Educación
- Ingeniería y construcción
- Fabricación
- Servicios financieros
- Seguros
- Productos químicos
Cumplimiento de la normativaCasos prácticosCentro de AprendizajeMarco y prácticas - Sobre nosotrosÉxito del clienteSociosSobre nosotrosÉxito del clienteSocios



Sistema de gestión de calidad (SGC)
Please Select contact form.
Descubra cómo la interfacing puede ayudarlo a mejorar su programa de sistema de gestión de calidad

Acerca del sistema de gestión de la calidad (SGC)
Según ASQ (Sociedad Americana de Calidad): El sistema de gestión de la calidad (SGC) se define como un sistema formalizado que documenta los procesos, procedimientos y responsabilidades para lograr las políticas y los objetivos de la calidad.
Un SGC ayuda a coordinar y dirigir las actividades de una organización para cumplir con los requisitos reglamentarios y del cliente y mejorar su eficacia y eficiencia de forma continua.
ISO 9001: 2015, la norma internacional que especifica los requisitos para los sistemas de gestión de la calidad, es el enfoque más destacado de los sistemas de gestión de la calidad. Si bien algunos usan el término “QMS” para describir el estándar ISO 9001 o el grupo de documentos que detallan el QMS, en realidad se refiere a la totalidad del sistema. Los documentos solo sirven para describir el sistema.

Sistema de Gestión de la Calidad Empresarial (SGCE)
Hoy en día, las organizaciones están obligadas a garantizar la calidad, el cumplimiento y muchas otras normativas específicas del sector en relación con sus procesos de producción y prestación de servicios. Para garantizar que estas normativas cumplen las normas del sector, las empresas adoptarán una solución de sistema de gestión de la calidad eQMS.
Estas soluciones de SGCe han ido cambiando progresivamente con el tiempo, habiendo empezado siendo hojas de cálculo básicas en un principio. Las empresas aprovecharían estas hojas de cálculo en el seguimiento y la gestión de sus procesos de calidad. Con la evolución de los recursos informáticos, los sistemas eQMS surgieron como soluciones de software fiables que ejecutan procesos, identifican responsabilidades y detallan procedimientos para la consecución de objetivos y el cumplimiento de políticas. Piensa en ello como una plataforma de SGC que se integra con una infraestructura informática y un modelo de datos que facilitan la colaboración y la comunicación interfuncionales.
Aunque hay capacidades personalizadas variables integradas en función del sector, las plataformas de entrega, el tamaño de la organización, etc., hay unas cuantas capacidades típicas en las que se suele invertir. Entre ellas estarían:
- Plataforma web
- Adoptar un enfoque BPM de la funcionalidad implica que las aplicaciones se construyan sobre una plataforma con integración a otras aplicaciones.
- Interoperabilidad con otras aplicaciones de Planificación de Recursos Empresariales (ERP).
- La GUI está basada en roles y se centra en la ejecución del proceso del flujo de trabajo.
ISO 9001:2015
Definición
ISO 9001 es la norma mundial que determina y define los requisitos de un sistema de gestión de la calidad (SGC). Esta norma la utilizan las organizaciones para proporcionar de forma coherente productos y servicios que deben cumplir los requisitos del cliente y los reglamentarios. De todas las normas ISO 9000, ésta es la más popular y la única que pueden certificar las organizaciones de todo el mundo.
Historia
Publicada por primera vez en 1987 por la Organización Internacional de Normalización (ISO), la norma ISO 9001 fue introducida y aceptada entre los organismos nacionales de normalización de más de 160 países. La versión más reciente de la norma ISO 9001 se publicó en septiembre de 2015 (ISO 9001:2015).
Funcionalidades de EQMS
Hay muchas razones para utilizar el SGC: facilitar la investigación de acontecimientos adversos y factores precedentes para aplicar medidas correctoras, gestionar el cumplimiento, gestionar el riesgo y muchas otras. La lista que figura a continuación es muy amplia y sirve de apoyo a EQMS:
- No Conformidades / Acciones Correctivas y Preventivas (NC/CAPA)
- Gestión del cumplimiento
- Gestión de la calidad de los proveedores
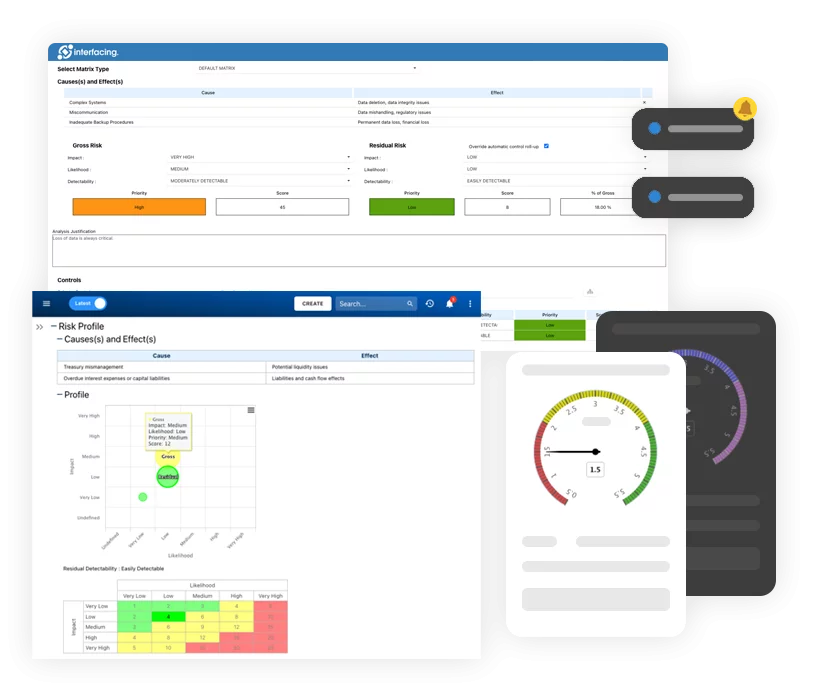
- Gestión de riesgos
- Análisis modal de fallos y efectos (AMFE)
- Tramitación de reclamaciones
- Medio ambiente, salud y seguridad (EH&S)
- Gestión de auditorías
- Gestión del cambio
- Informar
- RIMS
- Vigilancia
- Control de documentos
- Gestión de la calibración
- Formación de empleados
La ventaja de EQMS
El SGC basado en papel posee las herramientas adecuadas para guiar a una organización a través de eventos específicos de forma individual. Sin embargo, con el tiempo, surgieron desafíos que surgieron con algunos de los aspectos más básicos para mantener los eventos organizados y de fácil acceso en toda la organización.
Al pasar a un EQMS, las organizaciones toman el proceso manual de QMS y crean flujos de datos en los que se introducen la recuperación y recuperación de datos históricos, el análisis de eventos, el análisis de tendencias y una gran cantidad de otros análisis que brindan una visión profunda, informes y soluciones de inmediato. A continuación se indican algunas ventajas de un EQMS:
Problemas comunes del SGC
- Trazabilidad limitada de los procesos y la documentación
- Demasiadas reuniones de comprobación del progreso para todos los asistentes
- El acceso al archivo en papel es un reto
- Proceso complejo para completar una gestión y un análisis de riesgos precisos
- Alto riesgo de pérdida o archivo incorrecto de la documentación
- Registros en circulación desincronizados u obsoletos
- La falta de firmas durante una auditoría supone un alto riesgo
- Falta de responsabilidad y visibilidad dentro de los equipos
- La ineficacia y los errores provocan un elevado coste para mantener la calidad
Ventaja EQMS
- Se mantiene un registro detallado de todas las revisiones, firmas y actualizaciones, almacenado en un repositorio central seguro.
- Notificaciones de cambios y solicitudes Envío automático a personal específico
- Notificaciones de cambios y solicitudes Envío automático a personal específico
- Notificaciones de cambios y solicitudes Envío automático a personal específico
- Control electrónico de documentos con integración API en centros de datos basados en la nube
- Control de documentos establecido con estado y versionado
- Cualquier documento sin firmar se marcaría automáticamente
- Registro de revisiones, fechas y empleados autores o revisores de los documentos.
- Reducción significativa de los costes al disminuir el margen de error
Una solución diseñada para las necesidades de la industria moderna
Las empresas que se mudan a EQMS se han asociado con Interfacing para implementar soluciones de flujo de trabajo que involucran la administración y automatización de procesos comerciales punto a punto. Esto incluye las ciencias de la salud (incluidas las relacionadas con el paciente), la fabricación, los procesos administrativos, financieros y de la industria, por ejemplo.
La optimización y automatización de procesos de interconexión, la digitalización de la documentación SOP y la solución de vigilancia regulatoria proactiva, Enterprise Process Center © Suite ha generado importantes ahorros de tiempo con aprobación y validación aceleradas, visibilidad mejorada y mejoras operativas para los clientes, que incluyen lo siguiente:
Alineación de extremo a extremo – Fuente única de la verdad
El EPC permite a su organización alinear fácilmente departamentos, regulaciones, procedimientos, controles, dentro de un único repositorio para permitir mejoras continuas rápidas y estandarizadas. Nuestra tecnología permite fragmentar la información para construir fragmentos de datos reutilizables.
Aprobaciones y validación aceleradas
La solución EQMS de interfaz ofrece un ahorro de tiempo sostenido al reducir el tiempo de capacitación, actualización y reentrenamiento. El flujo de trabajo integrado de aprobación, revisión y aprobación también ayuda a agilizar la validación de la nueva versión de los procedimientos operativos estándar (SOP) a través de ciclos fragmentados de revisión y aprobación de contenido para ayudar a la toma de decisiones.
Firma digital y autenticación multifactor
EPC cumple con los requisitos muy estrictos asociados con el cumplimiento de los programas FSA QSR, ISO 9000, ISO 13845, GxP, por ejemplo, y todos los SOP y procesos se analizan y documentan, lo que proporciona pistas de auditoría que cumplen con 21 CFR Parte 11 Registro electrónico y firma electrónica. (ERES) y una serie de otros requisitos reglamentarios a través del cifrado RSA, la historia de la clave de la bóveda y la autenticación multifactor (MFA)
Velocidad y agilidad mejoradas
Enterprise Process Center © Suite de Interfacing es totalmente móvil y digital, lo que le brinda a su organización la flexibilidad de una documentación de calidad fácilmente visible a través de una variedad de medios, incluidos teléfonos, tabletas, gráficos y textuales para aumentar la agilidad y la autoformación de los empleados.
Soporte multi-idioma, traducción automática y contenido localizado
Enterprise Process Center© Suite de Interfacing proporciona formas perspicaces de administrar el contenido global, ya sea mediante sugerencias de traducción automatizadas para todos los fragmentos de contenido, o la capacidad de recopilar varianza para los SOP por país, región o tipo de producto
Comprender el cumplimiento: ISO 9001, ISO 13485, FDA QSR y GxP
Entendemos que los requisitos impuestos a las organizaciones en términos de cumplimiento son muy altos y que ISO 9000, ISO 13845, FDA QSR y GxP es una parte esencial de ese programa. Al utilizar nuestras soluciones, su empresa obtiene la responsabilidad y la coherencia que le brindarán una ventaja sobre la competencia.
Nuestras herramientas garantizan una visibilidad completa de extremo a extremo, desde la creación y modificación de un reglamento hasta la aprobación y revisión del contenido hasta la actualización y readaptación de los empleados para los procedimientos operativos estándar (SOP). Vemos la administración completa del ciclo de vida como partes móviles de un ecosistema completo y es por eso que son un enfoque único que combina los requisitos reglamentarios, documentos, procesos, instrucciones de trabajo y gobernanza.
ISO 9001
Estándar internacional que especifica los requisitos de un SGC. Es el estándar más popular de la serie ISO 9000 y el único estándar de la serie que las organizaciones pueden certificar.
ISO 13485
En resumen, ISO 13485 es un estándar reconocido internacionalmente que han adoptado los siguientes países: Europa, Canadá, Australia y otros mercados. Excluyendo Canadá, la aplicación de ISO 13485 no es un requisito, pero es el estándar de facto que se usa hoy en día como una medida del cumplimiento total del SGC establecido en las regulaciones de dispositivos médicos.
US FDA QSR
La QSR de la FDA de EE. UU. (También conocida como 21 CFR Parte 820) se introdujo antes de la norma ISO 13485. Todas las empresas de dispositivos médicos en los EE. UU. Deben cumplir con este estándar para la distribución nacional, pero deben cumplir con ambas regulaciones para distribuir dispositivos a nivel internacional. Las QSR de la FDA de EE. UU. También deben ser satisfechas por las empresas internacionales que deseen hacer negocios con clientes de EE. UU.
QMS matizado
Otros países tendrán sus propios criterios para cumplir con los requisitos específicos del SGC. Por ejemplo, si bien Brasil y Japón tienen sus propios requisitos, ambos se basan en las normas QSR e ISO 13485 de la FDA de EE. UU. Existentes. En una nota positiva, estos estándares logran requisitos de gestión de calidad armonizados para cumplir con los estándares de QMS de EE. UU., Canadá, Europa y todos los demás vigentes.
Cumplimiento de GxP
Nuestro enfoque puede ayudar con todas las regulaciones y cumplimientos relacionados con la producción farmacéutica y dispositivos médicos (GxP, CFR, GCP, GLP, GMP, HIPAA, ISO9001, regulaciones de dispositivos médicos, SOX, BITS, CSA, FDA, FedRAMP, FIPS, FISMA, MHRA, NISP DoD, PCI DSS, SOC 2, U.S. SEC 17a-4 entre otros).
Administrar contenido
Gestione los elementos individuales de información, asigne propietarios y garantice la gobernanza a través de ciclos de aprobación y solicitudes de cambio.
Firma digital
Admitimos plenamente la firma digital para garantizar que la pista de auditoría de todo el contenido sea segura, con marca de tiempo, con copias precisas y completas de los registros disponibles para su inspección durante todo el período de retención.
Garantizar la transparencia
Visibilidad completa para comprender dónde se utilizan los registros y su aplicabilidad. También puede mantener contenido digital con una clara rendición de cuentas, incluidos roles y responsabilidades.
Realizar análisis de impacto
Analice sus registros en busca de impactos posteriores y analice los posibles impactos en políticas, SOP, unidades de negocio y registros relacionados.
SOP digitales
Genere una salida personalizable completa de procesos y registros relacionados, como regulaciones en un formato Word listo para imprimir y exportar. ¡Ya no necesita administrar SOP en papel! El SOP digital está sincronizado todo el tiempo.
Flujo de trabajo de aprobación y gobernanza
Flujos de trabajo de aprobación integrados e integrados para garantizar un control estricto sobre el cambio de los registros, incluida la validación de cambios, la evaluación de impactos y el resaltado de los cambios.
Fomentar la colaboración
Al unir objetivos y crear un marco común para sus equipos, podrán cooperar estratégicamente, crear solicitudes de cambio y asignar tareas a los implementadores.
Compromiso con el Cumplimiento
En Interfacing, el cumplimiento es el núcleo de nuestra misión. Trabajamos constantemente para ayudar a nuestros clientes a alcanzar y mantener una total conformidad regulatoria, asegurando que sus operaciones cumplan con los estándares globales.
Excelencia Certificada ISO 27001
Interfacing cuenta con la certificación ISO 27001, lo que refleja nuestro compromiso con una gestión sólida de la seguridad de la información. Esta certificación destaca nuestra dedicación a ofrecer soluciones seguras y confiables para nuestros clientes.
Asociación con AWS para Hosting en la Nube Avanzado
Al asociarnos con Amazon Web Services (AWS), garantizamos servicios de hosting en la nube de primera clase respaldados por una conformidad probada. Los centros de datos globales de AWS cumplen con estrictos estándares como SOC 1 Tipo II e ISO 27001. Para obtener más detalles sobre el cumplimiento de AWS con ISO 18345, FDA QSR y GxP, consulte su programa integral de cumplimiento.
¿Por qué elegir Interfacing?
Con más de dos décadas de experiencia en software de IA, Calidad, Procesos y Cumplimiento, Interfacing sigue siendo líder en el sector. Hasta la fecha, ha prestado servicio a más de 500 empresas de talla mundial y consultoras de gestión de todas las industrias y sectores. Seguimos ofreciendo soluciones digitales, en la nube y de IA que permiten a las organizaciones mejorar, controlar y agilizar sus procesos, al tiempo que alivian la carga de los programas de cumplimiento normativo y gestión de la calidad.
Para obtener más información o hablar sobre cómo Interfacing puede ayudar a su organización, rellene el siguiente formulario.

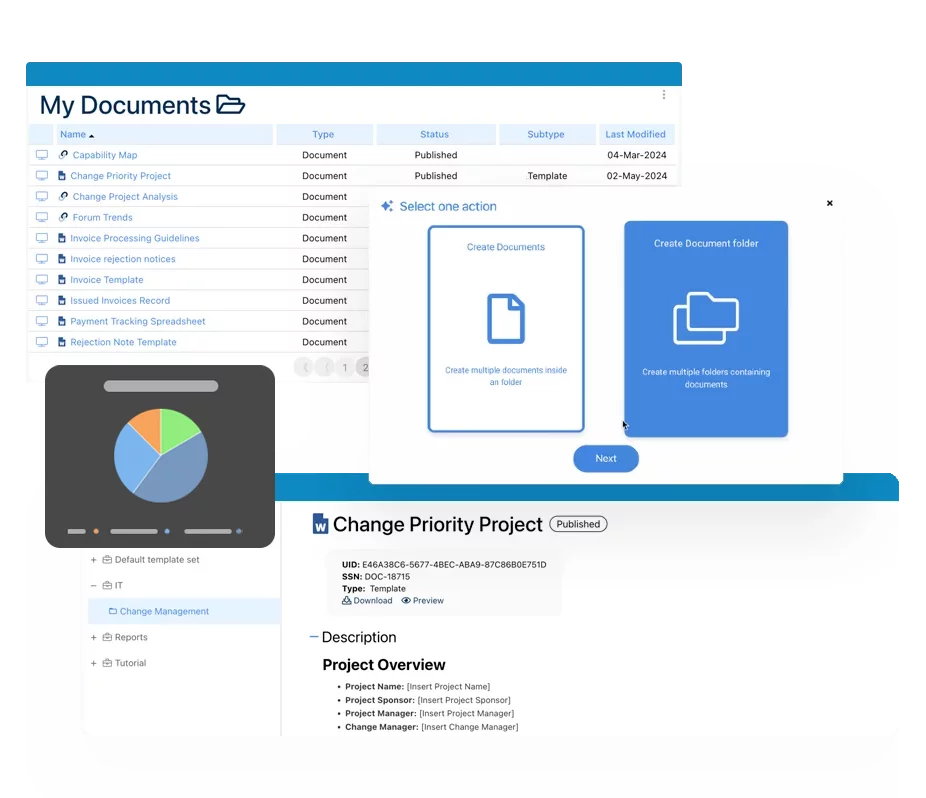
Documentación: Impulsando la Transformación, Gobernanza y Control
• Obtenga información integral en tiempo real sobre sus operaciones.
• Mejore la gobernanza, eficiencia y cumplimiento.
• Garantice la alineación fluida con los estándares regulatorios.

eQMS: Automatización de flujos de trabajo y reportes de calidad y cumplimiento
• Simplifique la gestión de calidad con flujos de trabajo automatizados y monitoreo..
• Optimice CAPA, auditorías de proveedores, capacitaciones y flujos relacionados..
• Transforme la documentación en información procesable para Calidad 4.0.
.

Desarrollo rápido de aplicaciones low-code: Acelerando la transformación digital
• Cree aplicaciones personalizadas y escalables de forma ágil.
• Reduzca el tiempo y costo de desarrollo.
• Adáptese rápidamente y manténgase ágil frente a las necesidades cambiantes de clientes y negocios.

¡IA para transformar su negocio!
Las herramientas impulsadas por IA están diseñadas para optimizar operaciones, mejorar el cumplimiento y fomentar el crecimiento sostenible. Descubra cómo la IA puede:
• Responder a las consultas de los empleados.
• Transformar videos en procesos.
• Formular recomendaciones sobre el impacto de la regulación y la mejora de los procesos
• Generar formularios electrónicos, procesos, riesgos, regulaciones, KPIs y mucho más.
• Desglosar estándares regulatorios en requisitos desagregados.

Solicite una demostración gratuita
Con la confianza de Clientes en todo el mundo
Más de 400+ empresas y consultoras de gestión de talla mundial



















































Integración
Con la confianza de Clientes en todo el mundo Integración
Más de 400+ empresas y consultoras de gestión de talla mundial



























