- Geschäftsprozessmanagement (BPM)Dokumenten-Management-System (DMS)Elektronisches Qualitätsmanagementsystem (QMS)Risk, Governance & Compliance (GRC)Schnelle Anwendungsentwicklung mit wenig Code (LC)Betriebliches Kontinuitätsmanagement (BCM)Unternehmensarchitektur (EA)Geschäftsprozessmanagement (BPM)
- Geschäftsprozessmanagement Übersicht
- AI Prozess-Parsing, -Generierung, -Analyse & -Verbesserung
- Prozess-Mapping / Modellierung
- Prozess-Analyse und Verbesserung
- Prozess-Simulation
- Prozess-Mining
- Zusammenarbeit & Governance
- Data Migration und Integration
- Anbindung der Offline-App
 Dokumenten-Management-System (DMS)
Dokumenten-Management-System (DMS)- Dokumentenlenkung Übersicht
- KI-Inhaltserstellung und -verbesserung
- Verwaltung von Richtlinien und Verfahren (SOP)
- Zusammenarbeit & Governance
- Data Migration und Integration
- Anbindung der Offline-App
 Elektronisches Qualitätsmanagementsystem (QMS)
Elektronisches Qualitätsmanagementsystem (QMS)- Überblick über das Qualitätsmanagementsystem
- Dokumente Control & Aufzeichnungen Mgmt
- Audit & Akkreditierung Mgmt
- Korrektur- und Präventivmaßnahmen
- Qualitätsereignis (nicht konform/konform), beschwerde, konformität
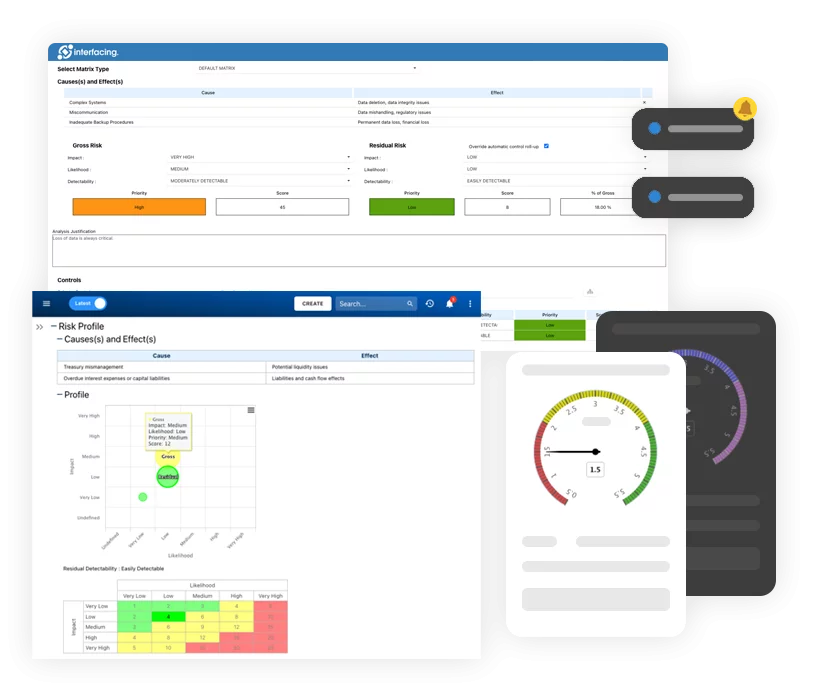
- Risikomanagement
- Management von Vorfällen
- Umwelt, Gesundheit und Sicherheit
- Produkt- und Lieferantenmanagement (SCAR)
- Ausbildung Management
- Control Management
- Aktionspunkte Management
- Management Review
- FMEA
- Pharmakovigilanz
- Data Migration und Integration
 Risk, Governance & Compliance (GRC)
Risk, Governance & Compliance (GRC)- Überblick zu Risiko, Governance & Compliance
- Risikomanagement und Kontrolle
- Einhaltung gesetzlicher Vorschriften
- Zusammenarbeit & Governance
- Data Migration und Integration
- Anbindung der Offline-App
 Schnelle Anwendungsentwicklung mit wenig Code (LC)
Schnelle Anwendungsentwicklung mit wenig Code (LC)- Low-Code-Automatisierungsplattform Übersicht
- Gestaltung elektronischer Webformulare (eFORMS)
- Low-Code-Automatisierungsplattform Übersicht
- Datenbank Tabelle Entity Designer
- Konzeption und Management von Aufgaben
- Entwurf und Verwaltung von BPMS-Anwendungen
- Integration mit externen Ressourcen und Anwendungen
- Definieren & Verwalten von Regeln/ Kontrollen/ Aktionen
- Elektronische Dienstleistungen
- Benutzer Startseite
- BAM (Business Activity Monitoring)
- Benutzerdefiniertes Dashboard-Design
- Data Migration und Integration
 Betriebliches Kontinuitätsmanagement (BCM)
Betriebliches Kontinuitätsmanagement (BCM)- BCM-Übersicht
- Analyse der geschäftlichen Auswirkungen
- Katastrophenschutz-Simulation
- Verwaltung der Handlungspunkte
- Verwaltung von Massenbenachrichtigungen
- Vermögensverwaltung
- Data Migration und Integration
 Unternehmensarchitektur (EA)
Unternehmensarchitektur (EA) Beratungsdienste
Interfacing ist hier, um Sie bei allen Transformationsinitiativen zu begleiten.
- Einhaltung gesetzlicher VorschriftenAnwendungsfälleLernzentrumRahmen & PraktikenEinhaltung gesetzlicher VorschriftenAnwendungsfälle
- Qualitätsmanagement-System (QMS)
- Digitale Transformation
- Kontinuierliche Verbesserung
- Governance, Risiko & Compliance
- Wissensmanagement
- Systemimplementierung (ERP, CRM…)
 Lernzentrum
Lernzentrum- Gemeinschaftsportal
- Webinare
- Videos
- Was ist BPM?
- BPMN 2.0-Symbolik
- Prozess-Mapping vs. Modellierung
- Glossar
 Rahmen & Praktiken
Rahmen & Praktiken - Über unsKundenerfolgPartnerÜber unsKundenerfolgPartner



Einhaltung von Vorschriften
Please Select contact form.
Ist Ihr Unternehmen konform? Erfahren Sie mehr über die verschiedenen gesetzlichen Vorschriften und wie Interfacing Ihnen helfen kann.

Ist Ihr Unternehmen konform?
Erfahren Sie mehr über die verschiedenen gesetzlichen Vorschriften und wie Interfacing Ihnen helfen kann.
Die Einhaltung von Prozessen - sei es durch staatliche Gesetze, Industriestandards und -vorschriften oder unternehmenseigene Richtlinien - ist für alle Unternehmen ein wichtiges Thema. Die Kosten der Nichteinhaltung können sowohl katastrophal als auch langwierig sein.
Die Nichtbeachtung von Vorschriften kann Ihr Unternehmen einem großen Risiko aussetzen, wenn Sie sich nicht an die Gesetze halten. Das Risiko der Rufschädigung und die finanziellen Auswirkungen sind erheblich. Die Einhaltung von Vorschriften, Gesetzen und Richtlinien kann eine schwierige Aufgabe sein, und Führungskräfte brauchen die richtigen Instrumente, um die Einhaltung der Vorschriften zu gewährleisten.
Eine Lösung, die für die Bedürfnisse der modernen Industrie entwickelt wurde
Unternehmen, die Compliance umsetzen, haben sich mit Interfacing zusammengetan, um Workflow-Lösungen zu implementieren, die die Verwaltung und Automatisierung von Punkt-zu-Punkt-Geschäftsprozessen beinhalten. Dazu gehören beispielsweise Prozesse in den Bereichen Gesundheitswissenschaften (einschließlich patientenbezogener Prozesse), Fertigung, Verwaltung, Finanzen und Industrie. Interfacing's Prozessoptimierung und -automatisierung, die Digitalisierung der SOP-Dokumentation und die proaktive Lösung zur Überwachung der Einhaltung von Vorschriften, die Enterprise Process Center© Suite, haben zu erheblichen Zeiteinsparungen durch beschleunigte Genehmigung und Validierung, verbesserte Sichtbarkeit und betriebliche Verbesserungen für Kunden wie die folgenden geführt:
Durchgängige Abstimmung - Single Source of Truth
Mit dem EPC kann Ihr Unternehmen auf einfache Weise Abteilungen, Vorschriften, Verfahren und Kontrollen in einem einzigen Repository abgleichen, um schnelle und standardisierte kontinuierliche Verbesserungen zu ermöglichen. Unsere Technologie ermöglicht die Fragmentierung von Informationen, um wiederverwendbare Datenfragmente zu erstellen.
Beschleunigte Genehmigungen und Validierungen
Die Verknüpfung mit der EQMS-Lösung führt zu einer nachhaltigen Zeitersparnis durch geringere Schulungs-, Aktualisierungs- und Umschulungszeiten. Der integrierte Genehmigungs-, Überprüfungs- und Bestätigungs-Workflow trägt auch dazu bei, die Validierung neuer Versionen der Standardarbeitsanweisungen (SOPs) durch fragmentierte Inhaltsüberprüfungs- und Genehmigungszyklen zu rationalisieren und die Entscheidungsfindung zu unterstützen.
Digitale Signatur und Multi-Faktor-Authentifizierung
EPC erfüllt die sehr strengen Anforderungen, die beispielsweise mit der Einhaltung von FSA QSR, ISO 9000, ISO 13845 und GxP-Programmen verbunden sind. Alle SOPs und Prozesse werden analysiert und dokumentiert und bieten Prüfprotokolle, die die Einhaltung von 21 CFR Part 11 Electronic Record and Electronic Signature (ERES) und einer Vielzahl anderer gesetzlicher Anforderungen durch RSA-Verschlüsselung, Vault Key Story und Multi-Factor-Authentifizierung (MFA) erfüllen.
Verbesserte Geschwindigkeit und Agilität
Die Enterprise Process Center© Suite von Interfacing ist vollständig mobil und digital und bietet Ihrer Organisation die Flexibilität einer Qualitätsdokumentation, die über eine Vielzahl von Mitteln wie Telefon, Tablet, Grafik und Text sichtbar ist, um die Agilität und das Selbsttraining der Mitarbeiter zu fördern.
Mehrsprachige Unterstützung, automatische Übersetzung und lokalisierte Inhalte
Die Enterprise Process Center© Suite von Interfacing bietet aufschlussreiche Möglichkeiten zur Verwaltung globaler Inhalte, sei es durch automatische Übersetzungsvorschläge für alle Inhaltsfragmente oder durch die Möglichkeit, Abweichungen für SOPs nach Land, Region oder Produkttyp zu sammeln
Verständnis für die Einhaltung von Vorschriften: ISO 9001, ISO 13485, FDA QSR und GxP
Wir wissen, dass die Anforderungen an Medizinprodukteunternehmen in Bezug auf die Einhaltung von Vorschriften sehr hoch sind und dass ISO 9001, ISO 13845, FDA QSR und GxP ein wesentlicher Bestandteil dieses Programms sind. Durch den Einsatz unserer Lösungen erhält Ihr Unternehmen die Verantwortlichkeit und Konsistenz, die Ihnen einen entscheidenden Vorteil gegenüber Ihrer Konkurrenz verschafft. Unsere Tools gewährleisten volle Transparenz von Anfang bis Ende, von der Erstellung und Änderung einer Vorschrift über die Genehmigung und Überarbeitung des Inhalts bis hin zur Aktualisierung und Umschulung der Mitarbeiter für Standardarbeitsanweisungen (SOPs). Wir sehen das Management des gesamten Lebenszyklus als bewegliche Teile eines kompletten Ökosystems und verfolgen daher einen einzigartigen Ansatz, der gesetzliche Anforderungen, Dokumente, Prozesse, Arbeitsanweisungen und Governance miteinander verbindet.
ISO 9001
Internationale Norm, welche die Anforderungen an ein QMS festlegt. Sie ist die am weitesten verbreitete Norm der ISO 9000-Reihe und die einzige Norm in der Reihe, nach der sich Unternehmen zertifizieren lassen können. Erstmals 1987 von der International Organization for Standardization (ISO) veröffentlicht. Die aktuelle Version der ISO 9001 wurde im September 2015 veröffentlicht.
ISO 13485
ISO 13485 ist ein international anerkannter Standard, der in folgenden Ländern eingeführt wurde: Europa, Kanada, Australien und anderen Märkten. Mit Ausnahme von Kanada ist die Anwendung der ISO 13485 nicht obligatorisch, aber sie ist die de facto Norm, die heute als Maßstab für die vollständige Einhaltung der in den Medizinproduktevorschriften festgelegten QMS verwendet wird.
US FDA QSR
Die US FDA QSR (auch bekannt als 21 CFR Part 820) wurde vor der ISO 13485 eingeführt. Alle Hersteller von Medizinprodukten in den USA müssen diese Norm für den nationalen Vertrieb erfüllen, für den internationalen Vertrieb von Produkten müssen jedoch beide Vorschriften eingehalten werden. Auch internationale Unternehmen, die mit US-Kunden Geschäfte machen wollen, müssen den QSR der US FDA erfüllen.
Ein abgestimmtes Qualitätsmanagementsystem (QMS)
Andere Länder haben eigene Kriterien, um differenzierte QMS-Anforderungen zu erfüllen. Beispielsweise haben Brasilien und Japan ihre eigenen Anforderungen, aber beide basieren auf den bestehenden Standards QSR der US FDA und ISO 13485. Positiv zu vermerken ist, dass mit diesen Normen harmonisierte Qualitätsmanagementanforderungen erreicht werden, die den US-amerikanischen, kanadischen, europäischen und allen anderen anwendbaren QMS-Normen entsprechen.
GxP-Einhaltung
Unser Ansatz unterstützt Sie bei allen regulatorischen und Compliance-Anforderungen im Zusammenhang mit der Herstellung von Pharma- und Medizinprodukten (GxP, CFR, GCP, GLP, GMP, HIPAA, ISO9001, Medical Device Regulations, SOX, BITS, CSA, FDA, FedRAMP, FIPS, FISMA, MHRA, NISP DoD, PCI DSS, SOC 2, U.S. SEC 17a-4 und andere).
Verwaltung von Inhalten
Verwalten Sie individuelle Informationen, weisen Sie Verantwortlichkeiten zu und stellen Sie eine gute Verwaltung durch Genehmigungszyklen und Änderungsanfragen sicher.
Digitale Unterschrift
Wir unterstützen eine digitale Signatur, um sicherzustellen, dass der Prüfpfad aller Inhalte sicher ist, mit einem Zeitstempel versehen wird und genaue und vollständige Kopien der Dokumente während der gesamten Aufbewahrungsfrist zur Einsichtnahme zur Verfügung stehen.
Gewährleistung von Transparenz
Vollständige Transparenz, um nachvollziehen zu können, wo und in welchen Bereichen die Aufzeichnungen verwendet werden. Darüber hinaus können Sie digitale Inhalte mit klaren Verantwortlichkeiten, einschließlich Rollen und Zuständigkeiten, verwalten.
Durchführen einer Wirkungsanalyse
Analysieren Sie Ihre Dokumentation auf nachgelagerte Auswirkungen und untersuchen Sie die möglichen Auswirkungen auf Richtlinien, SOPs, Geschäftseinheiten und die zugehörige Dokumentation.
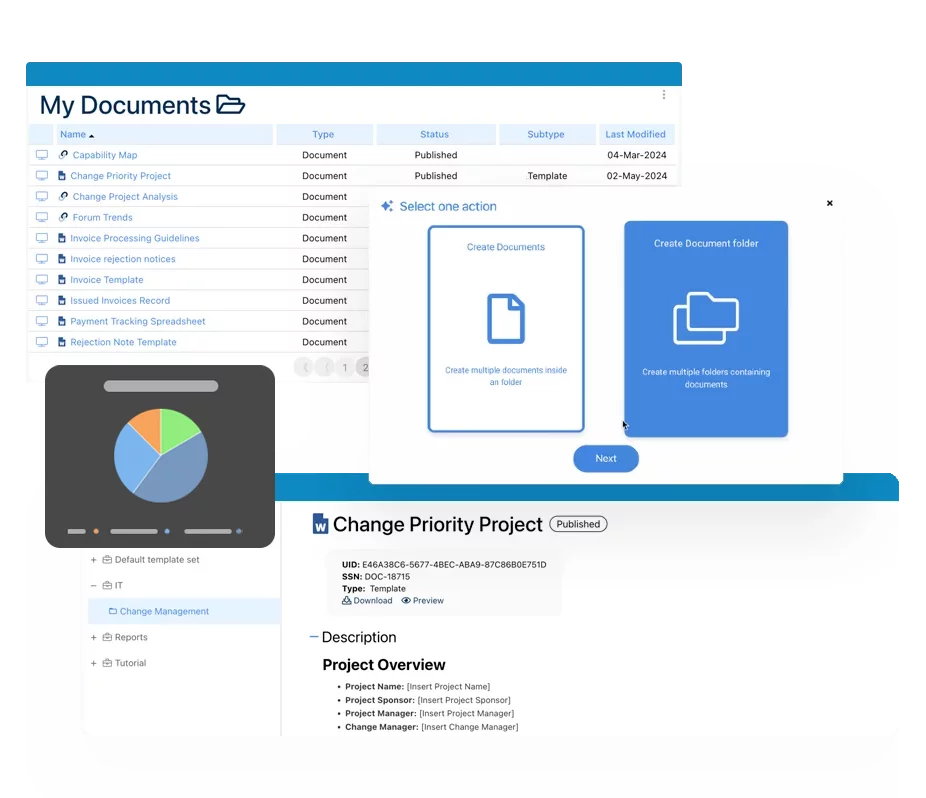
Digitale SOPs
Generieren Sie eine vollständig anpassbare Ausgabe von Prozessen und zugehörigen Aufzeichnungen, wie z.B. Vorschriften, in einem druckfertigen und exportierbaren Word-Format. Sie sind nicht mehr gezwungen, Ihre SOPs papierbasiert zu verwalten! Die digitale SOP ist zu jeder Zeit synchronisiert.
Genehmigungs- und Governance-Workflow
Integrierte und eingebettete Genehmigungsworkflows gewährleisten eine strenge Kontrolle von Änderungen an Ihren Aufzeichnungen. Dies umfasst die Validierung von Änderungen, die Bewertung ihrer Auswirkungen und die Hervorhebung von Änderungen.
Förderung der Zusammenarbeit
Durch die Vereinheitlichung der Ziele und die Schaffung eines gemeinsamen Rahmens für Ihre Teams sind diese in der Lage, strategisch zusammenzuarbeiten, Änderungsanträge zu formulieren und Aufgaben an die Ausführenden zu delegieren.
Engagement für Compliance
Bei Interfacing steht Compliance im Mittelpunkt unserer Mission. Wir setzen uns kontinuierlich dafür ein, unseren Kunden zu helfen, vollständige regulatorische Konformität zu erreichen und aufrechtzuerhalten, damit ihre Abläufe den globalen Standards entsprechen.
ISO 27001-Zertifizierte Exzellenz
Interfacing ist stolz darauf, ISO 27001-zertifiziert zu sein, was unser Engagement für ein starkes Informationssicherheitsmanagement unterstreicht. Diese Zertifizierung zeigt unser Bestreben, sichere und zuverlässige Lösungen für unsere Kunden bereitzustellen.
Partnerschaft mit AWS für fortschrittliches Cloud-Hosting
Durch die Partnerschaft mit Amazon Web Services (AWS) bieten wir erstklassige Cloud-Hosting-Dienste, die durch bewährte Compliance unterstützt werden. Die globalen Rechenzentren von AWS erfüllen strenge Standards wie SOC 1 Typ II und ISO 27001. Weitere Informationen zur AWS-Konformität mit ISO 18345, FDA QSR und GxP finden Sie in ihrem umfassenden Compliance-Programm.
Warum Interfacing wählen?
Mit mehr als zwei Jahrzehnten Erfahrung in den Bereichen KI, Qualität, Prozesse und Compliance ist Interfacing nach wie vor ein führendes Unternehmen in der Branche. Bis heute hat das Unternehmen mehr als 500 erstklassige Unternehmen und Unternehmensberatungen aus allen Branchen und Sektoren bedient. Wir bieten weiterhin digitale, Cloud- und KI-Lösungen an, die es Organisationen ermöglichen, ihre Prozesse zu verbessern, zu kontrollieren und zu rationalisieren und gleichzeitig die Last der Einhaltung von Vorschriften und Qualitätsmanagementprogrammen zu verringern.
Wenn Sie weitere Informationen wünschen oder besprechen möchten, wie Interfacing Ihr Unternehmen unterstützen kann, füllen Sie bitte das folgende Formular aus.

Dokumentation: Transformation, Governance und Kontrolle vorantreiben
· Gewinnen Sie in Echtzeitd umfassende Einblicke in Ihre Abläufe.
· Verbessern Sie Governance, Effizienz und Compliance.
· Sorgen Sie für nahtlose Einhaltung von regulatorischen Standards.

eQMS: Automatisierung von Qualitäts- und Compliance-Workflows und Berichten
· Vereinfachen Sie das Qualitätsmanagement mit automatisierten Workflows und Überwachung.
· Optimieren Sie CAPA, Lieferantenaudits, Schulungen und verwandte Workflows.
· Verwandeln Sie Dokumentation in
umsetzbare Erkenntnisse für Quality 4.0.

Low-Code Rapid Application Development: Beschleunigung der digitalen Transformation
· Erstellen Sie benutzerdefinierte, skalierbare Anwendungen schnell.
· Reduzieren Sie Entwicklungszeit und -kosten.
· Passen Sie sich schneller an und bleiben Sie agil angesichts sich wandelnder Kunden- und Geschäftsanforderungen.

KI zur Transformation Ihres Unternehmens!
KI-gestützte Tools sind darauf ausgelegt, Abläufe zu optimieren, Compliance zu verbessern und nachhaltiges Wachstum voranzutreiben. Erfahren Sie, wie KI:
· Mitarbeiterfragen beantworten kann.
· Videos in Prozesse umwandelt.
· Empfehlungen zur Prozessverbesserung und zu regulatorischen Auswirkungen gibt.
· eForms, Prozesse, Risiken, Vorschriften, KPIs und vieles mehr generiert.
· Regulatorische Standards in fragmentierte Anforderungen zerlegt.

Kostenlose Demo anfordern
Dokumentieren, analysieren, verbessern, digitalisieren und überwachen Sie Ihre Prozesse, Risiken, gesetzlichen Anforderungen und Leistungsindikatoren mit Interfacings integriertem Managementsystem Digital Twin, dem Enterprise Process Center®!
Kunden weltweit vertrauen auf uns
Mehr als 400 Unternehmen und Unternehmensberatungen von Weltrang



















































INTEGRATION
Kunden weltweit vertrauen auf uns
Mehr als 400 Unternehmen und Unternehmensberatungen von Weltrang



























